MnO4^- Cl^-=Cl2 Mn^ 2
来源:学生作业帮助网 编辑:作业帮 时间:2024/11/17 00:58:21
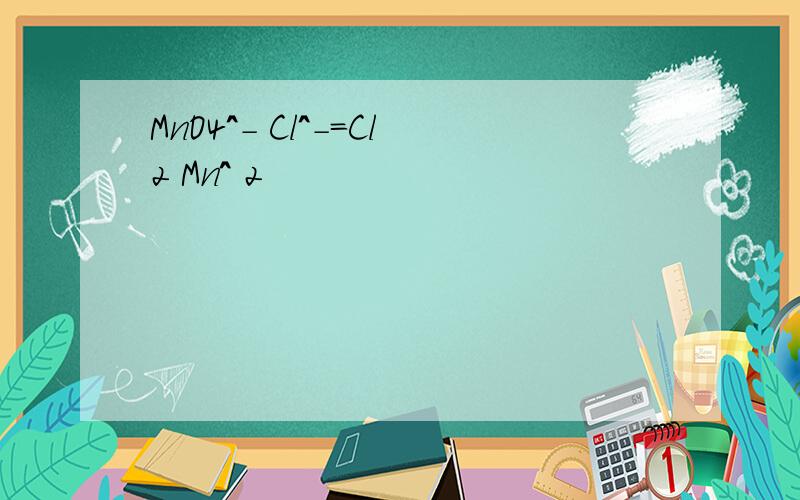
1、NO3-在酸性条件下会把Fe2+氧化成3价2、为表示方便,正负离子符号就不标了2H+CO3=H2O+CO2,H+HCO3=H2O+CO2没有SO2离子HSO3生成水和二氧化硫HS生成H2SPO4应
一定含有的离子CO3^2-、Na+不一定含有的离子Cl-、SO4^2-,一定不含有的离子Cu2+、MnO4-、Ag+、Ba2+、Al3+某无色溶液——排除Cu2+(蓝色)、MnO4-(紫红色)加入过量
溶液无色,说明不含MnO4-;①取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,说明甲为BaSO4,原溶液中含有0.01molSO42-;②向滤液中加
剩下就是原子个数守恒呀.2个MnO4-有8个O所以有8个H2O;需要16个H,5个H2O2已经有10个H,所以H+的系数就是6.【2MnO4-】+【5H2O2】+【6H+】=【2Mn2+】+【5O2】
溶液是无色溶液判断一定不含MnO4-;①取部分溶液,逐滴滴入NaOH溶液至过量,只观察到白色沉淀先增多后又部分溶解,无其它明显现象;说明一定含有Al3+、Mg2+;根据离子共存判断一定不含有HCO3-
肯定有na+,CO32-、SO42-肯定没有Ca2+,MnO4-Cl-可能有可能没有再问:为什么肯定有钠离子呢再答:你们老师说了一个分子中正离子和负离子相加要等于零的定律了吧。CO32-、SO42-这
5H2O2+2MnO4-+6H+==2Mn2++5O2↑+8H2O
①取部分溶液,加入适量Na2O2固体,过氧化钠先是和水反应生成氢氧化钠和氧气,产生无色无味的气体是氧气,一定不是氨气,此时白色沉淀出现,再加入足量的NaOH溶液后白色沉淀部分溶解,则沉淀的成分是氢氧化
在酸性条件下MnO4-具有强氧化性,Cl-会被氧化
(NH4)2MnO4+2Zn+8HCl==MnCl2+2ZnCl2+2NH4Cl+4H2O
含有的是Na+和SO3.2-,肯定没有的是MnO4-和CO3.2-不知道你的BL是不是Ba2+,如果是肯定也不含.方程式SO3.2-+2H+=SO2↑+H2O下次再提问的时候记得把问题全部传上来,不然
Mn为+7价,变为+2价,降5.O-1价,变为0价,2个O升高2.电子数Mn*2=O*5,再根据H个数配平水,2(MnO4-)+5H2O2+6(H+)====2(Mn2+)+5O2+8H2O
解题思路:KMnO4在酸性溶液中氧化性最强,一般还原产物为Mn2+在中性溶液中,通入SO2,由于SO2+H2O===H2SO3一般也可以写出Mn2+也有写成MnO2的但是在碱性溶液中MnO4―的还原产
由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;A、1molFe3+→Fe2+得1mole-,B、1molMnO4-→Mn2+得5mole-,C、1molCl2→2Cl-得2m
MnO4和S2-会发生氧气还原反应
①测定溶液的pH,溶液显强碱性;有OH-,无Cu2+,HCO3-(都要和碱反应)②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体;生成气体是CO2,所以有CO32-,无SO
该溶液是无色溶液,则一定不会含有高锰酸跟离子:①取部分溶液,加入过量Na2O2固体,过氧化钠先是和水反应生成氢氧化钠和氧气,产生无色无味的气体是氧气,一定不是氨气,说明不含铵根离子;白色沉淀逐渐增多后
2【MnO4-】+10【I-】+16【H+】=2【Mn2+】+5【I2】+8【H2O】
2(NH4)2MnO4+3Zn+16HCl=2MnCl3+3ZnCl2+4NH4Cl+8H2O