现有AlCl3和FeCl3混合溶液,其中Al3+、Fe3+的物质的量之和为0.1mol,在此溶液加入90mL4mol·L
来源:学生作业帮 编辑:大师作文网作业帮 分类:化学作业 时间:2024/11/19 03:14:15
现有AlCl3和FeCl3混合溶液,其中Al3+、Fe3+的物质的量之和为0.1mol,在此溶液加入90mL4mol·L-1的
NaOH溶液,使其充分反应,设Al3+物质的量与总物质的量的比值为x.
⑴根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
⑵计算沉淀中只有Fe(OH)3的x取值范围.
⑶若Al3+和Fe3+的物质的量之和为Amol (A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x取值范围和各沉淀的物质的量(用含有A、x的式子表示).
NaOH溶液,使其充分反应,设Al3+物质的量与总物质的量的比值为x.
⑴根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
⑵计算沉淀中只有Fe(OH)3的x取值范围.
⑶若Al3+和Fe3+的物质的量之和为Amol (A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x取值范围和各沉淀的物质的量(用含有A、x的式子表示).
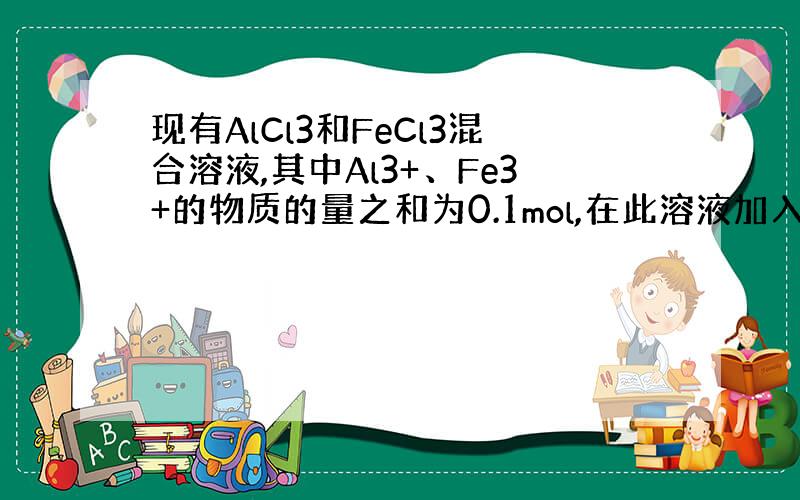
/>x=0.4 也就是Al3+0.04mol,Fe3+0.06mol
氢氧化钠0.09*4=0.36mol
氢氧化铁溶解度小所以生成0.06molFe(OH)3 消耗OH-0.18mol 剩余0.18mol
Al3+ + 4OH- =Al(OH)4-
氢氧化钠对于铝离子仍过量,所以,只有氢氧化铁生成,物质的量为0.06mol
x的最大取值为 0.1(1-x)×3+0.4x=0.09×4,x=0.6
∴在0≤x≤0.6时,沉淀只有Fe(OH)3
x=0时,Fe(OH)3沉淀量为0.1摩,
x=0.4时,Fe(OH)3沉淀量为0.06摩,
x=0.6时,Fe(OH)3沉淀量为0.04摩,
在0.6≤x≤1内,总沉淀量:
n总=0.1(1-x)+0.1x=0.04摩
( 0.36/A -3) < X <= 1
Fe(OH)3 A(1-X)
Al(OH)3 A(3+X) -0.6
氢氧化钠0.09*4=0.36mol
氢氧化铁溶解度小所以生成0.06molFe(OH)3 消耗OH-0.18mol 剩余0.18mol
Al3+ + 4OH- =Al(OH)4-
氢氧化钠对于铝离子仍过量,所以,只有氢氧化铁生成,物质的量为0.06mol
x的最大取值为 0.1(1-x)×3+0.4x=0.09×4,x=0.6
∴在0≤x≤0.6时,沉淀只有Fe(OH)3
x=0时,Fe(OH)3沉淀量为0.1摩,
x=0.4时,Fe(OH)3沉淀量为0.06摩,
x=0.6时,Fe(OH)3沉淀量为0.04摩,
在0.6≤x≤1内,总沉淀量:
n总=0.1(1-x)+0.1x=0.04摩
( 0.36/A -3) < X <= 1
Fe(OH)3 A(1-X)
Al(OH)3 A(3+X) -0.6
现有含0.04mol的ALCL3和0.06mol的FECL3的混合溶液110ml,向其中加入4mol/L的NAOH
现有浓度各为1mol\L 的fecl3 fecl2 cucl2的混合溶液1L 加入一定量铁粉
有硫酸钾和硫酸铝的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,而SO42-为0.7mol/L,则此溶液K
向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可
现有含CuSO4和H2SO4的混合溶液200ml,其中CuSO4物质的量浓度为1mol·L^-1若用此溶液和水及10mo
在K2SO4和Fe2(SO4)3的混合溶液中,已知Fe3+的物质的量浓度为0.1mol./L..
在50mLFeCI3和CuCI2的混合溶液中,FeCI3和CuCI2的物质的量浓度均为1mol/L.在此混合液中加入10
向1L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液
现有200mlH2SO4和NaSO4的混合溶液.其中,硫酸的物质的量浓度为1mol/L,硫酸钠的物质的量
现有0.40mol/LAlCl3和0.80mol/L FeCl3的混合溶液100mL,往其中逐滴加入一定浓度的NaOH溶
,题如下镁铝合金的混合物为0.1mol,其中镁粉的物质的量分数为a,用100ml4mol/L 的盐酸溶液溶解此混合物后,
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4:2:1,现加入适