Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则
来源:学生作业帮 编辑:大师作文网作业帮 分类:化学作业 时间:2024/11/12 16:30:44
 Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:①该温度下,水的离子积常数Kw=______.
②该温度下,将10mL 0.1mol/L的稀硫酸与10mL 0.4mol/L的NaOH溶液混合后,溶液的pH=______,此时该溶液中由水电离的c(OH-)=______mol/L.(忽略体积变化)
Ⅱ.根据2CrO42-(黄)+2H+═Cr2O72-(橙)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,电解一段时间后,右边溶液逐渐由黄色变为橙色.图中右侧电极连接电源的______极,其电极反应式为______,通电完成后,若转移0.1mol电子,则阴极区和阳极区的质量差为______g.(已知电解前两极区溶液质量相同)
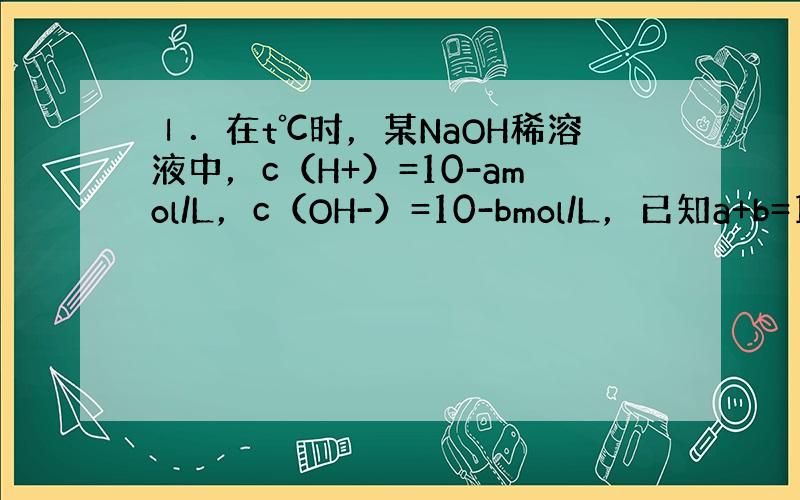
Ⅰ、①溶液中的离子积Kw=C(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-12;故答案为:10-12;
②酸中氢离子的物质的量=0.1mol/L×2×0.1L=0.02mol,碱中氢氧根离子的物质的量=0.4mol/L×0.1L=0.04mol/L,混合溶液中氢氧根离子浓度=
0.04mol−0.02mol
0.2L=0.1mol/L,c(H+)c(OH-)=10-12 ,溶液中氢离子浓度为10-11mol/L,则溶液的pH=11,水电离出c(OH-)=10-11mol/L,故答案为:11,10-11;
Ⅱ、根据2CrO42-+2H+⇌Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为2H2O-4e-=O2+4H+,通电完成后,若转移0.1mol电子,阳极电极反应:4OH--4e-=2H2O+O2↑,阴极电极反应2H++2e-=H2↑,2CrO42-+2H+=Cr2O72-+H2O,设原来溶液质量相同为m,依据溶液中电荷守恒,则阴极区和阳极区的质量差=m-0.05mol×2g/mol+0.1mol×23g/mol-(m-0.025mol×32g/mol-0.1mol×23g/mol)
=5.3g;
故答案为:正;2H2O-4e-=O2+4H+或4OH--4e-=2H2O+O2↑,5.3;
②酸中氢离子的物质的量=0.1mol/L×2×0.1L=0.02mol,碱中氢氧根离子的物质的量=0.4mol/L×0.1L=0.04mol/L,混合溶液中氢氧根离子浓度=
0.04mol−0.02mol
0.2L=0.1mol/L,c(H+)c(OH-)=10-12 ,溶液中氢离子浓度为10-11mol/L,则溶液的pH=11,水电离出c(OH-)=10-11mol/L,故答案为:11,10-11;
Ⅱ、根据2CrO42-+2H+⇌Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为2H2O-4e-=O2+4H+,通电完成后,若转移0.1mol电子,阳极电极反应:4OH--4e-=2H2O+O2↑,阴极电极反应2H++2e-=H2↑,2CrO42-+2H+=Cr2O72-+H2O,设原来溶液质量相同为m,依据溶液中电荷守恒,则阴极区和阳极区的质量差=m-0.05mol×2g/mol+0.1mol×23g/mol-(m-0.025mol×32g/mol-0.1mol×23g/mol)
=5.3g;
故答案为:正;2H2O-4e-=O2+4H+或4OH--4e-=2H2O+O2↑,5.3;
在t℃时,某NaOH的稀溶液中,c(H+)=10-amol.L-1,c(OH-)=10-bmol.L-1,
在T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向
在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=1
在T ℃时,某NaOH稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,
在50ml bmol/LAlCl3溶液中加入50ml amol/L的NaOH溶液 1、当a小于等于3b时生成Al(OH)
温度t℃时,某NaOH稀溶液中c(H + )=10 -a mol·L -1 ,c(OH - )=10 -b mol·L
.在100mL bmol/L AlCl3溶液中加入100mL amol/L NaOH溶液.(1)当a≤3b时,生成Al(
25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法正确的是( )
25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法不正确的是( )
在mml,bmol/lalci3溶液中,加入等体积amol/l的naoh溶液,(1)a≤3b生成al(oh)3 沉淀
在100ml bmol/L AlCl3 溶液中加入100mL amol/L NaOH溶液.问:当a ,b满足什么条件时,
NH4CL溶液的PH和稀盐酸的PH值均为5,其中由水电离出的C(H+)分别为Amol/L和Bmol则A与B的关系正确的是