关于弱电解质电离平衡(以CH3COOH←→CH3COO-+H+为例)
来源:学生作业帮 编辑:大师作文网作业帮 分类:化学作业 时间:2024/11/11 14:55:17
关于弱电解质电离平衡(以CH3COOH←→CH3COO-+H+为例)
(1)电离程度大小是看转化率,还是只要平衡向右移动,电离程度就越大?
(2)醋酸溶液中加少量浓H2SO4或加少量稀H2SO4或加大量H2SO4,c(H+)各怎么变?
(1)电离程度大小是看转化率,还是只要平衡向右移动,电离程度就越大?
(2)醋酸溶液中加少量浓H2SO4或加少量稀H2SO4或加大量H2SO4,c(H+)各怎么变?
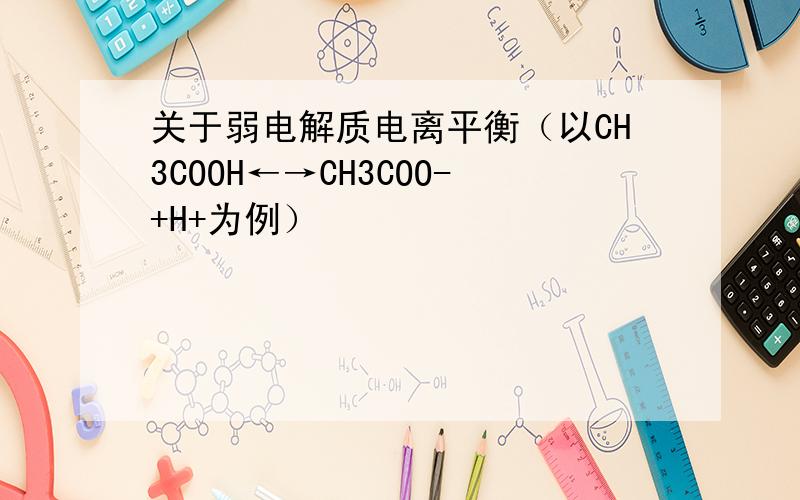
1.电离程度指的就是已电离的分子与原来的分子总数的比值大小,其实质就是该电离反应的转化率.所以比较电离程度的大小就是看转化率的大小.而平衡向右移动,电离程度不一定增大,比如加入醋酸分子.
2.溶液中氢离子浓度均增大
再问: 第二问,那电离程度怎么变化?如果加浓H2SO4的话,虽然c(H+)增大导致平衡逆向移动,但同时浓H2SO4溶于水还放热,又导致平衡正向移动,你怎么看?
再答: 在假设不放热的情况下,氢离子浓度尚且增大,如果放热的话,增加的就更多了
再问: 我说的是电离程度怎么变化。。。
再答: 电离程度不好说,应该不会有这么问的题目
2.溶液中氢离子浓度均增大
再问: 第二问,那电离程度怎么变化?如果加浓H2SO4的话,虽然c(H+)增大导致平衡逆向移动,但同时浓H2SO4溶于水还放热,又导致平衡正向移动,你怎么看?
再答: 在假设不放热的情况下,氢离子浓度尚且增大,如果放热的话,增加的就更多了
再问: 我说的是电离程度怎么变化。。。
再答: 电离程度不好说,应该不会有这么问的题目
关于弱电解质电离平衡(以CH3COOH←→CH3COO-+H+为例)
电解质、电离平衡问题1.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH = CH3COO- + H+要使溶
对于CH3COOH→(可逆符号)H++CH3COO-建立的电离平衡 加入冰醋酸,请说明为什么电离度减小
醋酸溶液中存在电离平衡CH3COOH⇌H++CH3COO-,若只改变下列条件之一,溶液中醋酸的电离平衡不移动的是( )
在0.10mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平
在0.1mol/LCH3COOH溶液中存在如下电离平衡 CH3COOH=CH3COO根+H离子 对于该平衡
在0.10mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确
1.温度为25℃时,50ml 0.1mol/L的醋酸存在如下平衡:CH3COOH←→CH3COO-+H+.若加入少量0.
问一个电离常数问题CH3COOH(可逆号)CH3COO-+H+ 加入等浓度的醋酸溶液,为什么平衡不移动,导电能力不变?
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO-+H+,要使溶液中c(H+)c(CH3COO
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO-+H+,要使溶液中 c
【高中化学】①溶液中CH3COO-和H+的物质的量浓度相等可证明CH3COOH达到电离平衡